Geben Sie ein Wort oder eine Phrase in einer beliebigen Sprache ein 👆
Sprache:
Übersetzung und Analyse von Wörtern durch künstliche Intelligenz
Auf dieser Seite erhalten Sie eine detaillierte Analyse eines Wortes oder einer Phrase mithilfe der besten heute verfügbaren Technologie der künstlichen Intelligenz:
- wie das Wort verwendet wird
- Häufigkeit der Nutzung
- es wird häufiger in mündlicher oder schriftlicher Rede verwendet
- Wortübersetzungsoptionen
- Anwendungsbeispiele (mehrere Phrasen mit Übersetzung)
- Etymologie
Was (wer) ist Адсорбция - definition
Хемосорбция; Адсорбант; Адсорбат; Десорбция; Физическая адсорбция
Адсорбция
(от лат. ad - на, при и sorbeo - поглощаю)
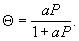
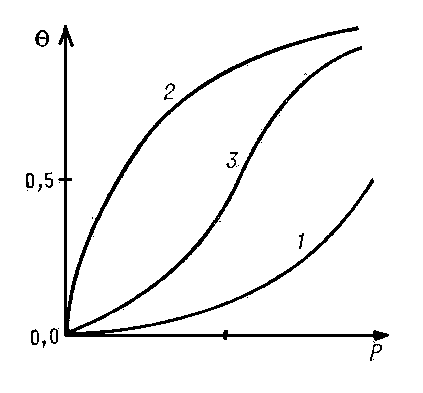
поглощение к.-л. вещества из газообразной среды или раствора поверхностным слоем жидкости или твёрдого тела. Например, если поместить в водный раствор уксусной кислоты кусочек угля, то произойдёт А. - количество кислоты в растворе уменьшится, молекулы кислоты сконцентрируются на поверхности угля. А. и Абсорбция - поглощение в объёме тела, объединяются общим термином Сорбция. Явление А. стало изучаться со 2-й половины 18 в. (Шееле, 1773), хотя несомненно, что в практической деятельности человечества А. использовалась с незапамятных времён. Учение об А. является частью более общей теории многокомпонентных гетерогенных систем, основы которой заложены У. Гиббсом (1876). Явление А. тесно связано с особыми свойствами вещества в поверхностном слое. например, молекулы, лежащие на поверхности раздела фаз жидкость - пар, втягиваются внутрь жидкости, т. к. испытывают большее притяжение со стороны молекул, находящихся в объёме жидкости, чем со стороны молекул пара, концентрация которых во много раз меньше концентрации жидкости. Это внутреннее притяжение заставляет поверхность сокращаться и количественно характеризуется поверхностным натяжением (См. Поверхностное натяжение). По той же причине молекулы какого-либо другого вещества, оказавшиеся вблизи поверхности, притянутся к ней и произойдёт А. После А. внутреннее притяжение частично компенсируется притяжением со стороны адсорбционного слоя и поверхностное натяжение уменьшается. Гиббс вывел формулу, связывающую значение А. с изменением поверхностного натяжения. Те вещества, А. которых сильно уменьшает поверхностное натяжение, принято называть поверхностно-активными.
Вещество, на поверхности которого происходит А., называется адсорбентом, а поглощаемое из объёмной фазы - адсорбатом. В зависимости от характера взаимодействия между молекулой адсорбата и адсорбентом А. принято подразделять на физическую А. и хемосорбцию. Менее прочная физическая А. не сопровождается существенными изменениями молекул адсорбата. Она обусловлена силами межмолекулярного взаимодействия, которые связывают молекулы в жидкостях и некоторых кристаллах и проявляются в поведении сильно сжатых газов. При хемосорбции молекулы адсорбата и адсорбента образуют химические соединения. Часто А. обусловлена и физическими и химическими силами, поэтому не существует чёткой границы между физикой А. и хемосорбцией.
Физически адсорбированные молекулы более или менее свободно перемещаются по поверхности, при этом их свойства часто аналогичны свойствам очень тонкого слоя газа, т. н. двухмерного газа. Они могут собираться группами, образуя слой двухмерной жидкости или двухмерного твёрдого тела. Адсорбированные молекулы рано или поздно покидают поверхность - десорбируются. Время, в течение которого молекула находится на поверхности, называется временем А. Времена А. могут колебаться в очень широких пределах. Скоростью А. (соответственно скоростью десорбции) называется количество молекул, адсорбирующихся (или десорбирующихся) за единицу времени, оба значения величин относят к единице поверхности или массы адсорбента. Скорость хемосорбции, как и скорость любого химического процесса, чаще всего увеличивается с повышением температуры (т. н. активированная А., см. Хемосорбция). Если скорости А. и десорбции равны друг другу, то говорят, что установилось адсорбционное равновесие. В состоянии равновесия количество адсорбированных молекул остаётся постоянным сколь угодно долго, если неизменны внешние условия (давление, температура и др.).
Адсорбированные молекулы не только совершают движение вдоль поверхности адсорбента, но и колеблются, то приближаясь к поверхности, то удаляясь от неё. Чем выше температура, тем интенсивнее колебательное движение, а стало быть, больше вероятность того, что в процессе таких колебаний связь молекулы с поверхностью будет разорвана и молекула десорбируется. Благодаря этому с ростом температуры уменьшается время А. и равновесное количество адсорбированных молекул.
С ростом концентрации или давления адсорбата в объёме увеличивается частота попаданий молекул адсорбата на поверхность адсорбента; пропорционально ей возрастает скорость А. и увеличивается равновесное количество адсорбированных молекул. Кривые зависимости равновесной А. от концентрации или давления адсорбата при постоянной температуре называются изотермами А.
Если адсорбат покрывает поверхность слоем толщиной в одну молекулу, А. называется мономолекулярной. Простейшая изотерма мономолекулярной А. представляет собой прямую линию, выходящую из начала координат, где на оси абсцисс отложено давление адсорбата Р, а на оси ординат степень заполнения поверхности Θ, т. е. доля поверхности, покрытая адсорбированными молекулами. Это - т. н. изотерма Генри:
Θ = kP.
Коэффициент пропорциональности k зависит главным образом от температуры и характера взаимодействия адсорбент - адсорбат.
Уравнение Генри справедливо при очень низких степенях заполнения для однородной поверхности. По мере увеличения степени заполнения всё большую роль начинает играть взаимодействие между адсорбированными молекулами и интенсивность их поверхностной подвижности. Если молекулы адсорбата притягиваются друг к другу, то каждая вновь адсорбирующаяся молекула будет испытывать притяжение и адсорбата и молекул, адсорбированных ранее. Поэтому, по мере заполнения поверхности, силы, удерживающие адсорбированную молекулу, будут увеличиваться и условия для А. будут всё более и более благоприятными. В этом случае с ростом давления изотерма всё круче и круче идёт вверх (см. кривую 1). Однако по мере заполнения поверхности вновь адсорбирующимися молекулами становится всё труднее найти свободное (не занятое др. молекулами адсорбата) место на поверхности. Поэтому с увеличением давления рост А. замедляется и степень покрытия стремится к постоянному значению, равному единице (см. кривую 2, которая характерна при отсутствии взаимного притяжения молекул адсорбата). Если действуют оба эти фактора, то получаются вогнуто-выпуклые изотермы (см. кривую 3).
Выпуклые изотермы (см. кривую 2) часто описывают уравнением Ленгмюра
Здесь а - адсорбционный коэффициент, аналогичный по физическому смыслу константе Генри k. Уравнение Ленгмюра справедливо для мономолекулярной А. на однородной поверхности, если можно пренебречь притяжением молекул адсорбата между собой и их подвижностью вдоль поверхности.
При дальнейшем увеличении давления происходит заполнение второго, третьего и т. д. слоев, т. е. имеет место полимолекулярная А. Если адсорбент имеет узкие поры и смачивается адсорбатом (см. Смачивание), то в порах может произойти конденсация при давлениях более низких, чем давление насыщенного пара адсорбата. Это явление называется капиллярной конденсацией (См. Капиллярная конденсация). Поверхность твёрдых адсорбентов (См. Адсорбенты) чаще всего неоднородна по адсорбционным свойствам: одни участки поверхности адсорбируют лучше, другие - хуже. При малых давлениях преобладает А. на наиболее активных участках поверхности, с увеличением давления заполняются менее активные участки. Однако, строго говоря, А. происходит одновременно на всей поверхности, и получаемая на опыте изотерма представляет собой сумму изотерм, каждая из которых соответствует определённому типу поверхности. Благодаря этому экспериментальные изотермы мономолекулярной А. могут существенно отличаться от кривых, приведённых на рис.
Почти всегда процесс А. сопровождается выделением тепла, называемой теплотой А. Хотя теплота А. не является единственным фактором, характеризующим прочность А., однако чаще всего чем прочнее А., тем больше её теплота. Теплота хемосорбции обычно составляет несколько десятков ккал/моль, теплота физической А. редко превосходит 10 ккал/моль (40 кдж/моль). По мере заполнения неоднородной поверхности теплота А. обычно уменьшается. При переходе в область полимолекулярной А. теплота А. понижается до величины, близкой к теплоте конденсации адсорбата.
А. играет важную роль при теплообмене между газообразными, жидкими и твёрдыми телами. например, молекулы газа, адсорбируясь на горячей поверхности, приобретают энергию, соответствующую температуре поверхности, и после десорбции сообщают эту энергию другим молекулам газа, нагревая его. Это не единственный, но важный механизм теплообмена.
А.- один из решающих факторов в стабилизации коллоидных систем (см. Дисперсные системы, Мицелла, Коагуляция) и одна из важнейших стадий реакций в гетерогенных системах, в частности в гетерогенном катализе (см. Топохимические реакции, Катализ). В биологических системах А. - первая стадия поглощения субмикроскопическими коллоидными структурами, органеллами, клетками и тканями различных веществ из окружающей среды, функционирование биологических мембран, первые этапы взаимодействия ферментов с субстратом, защитные реакции против токсичных веществ, процессы всасывания - всё это связано с А. Многие адсорбенты (активный уголь, каолин, иониты и др.) служат противоядиями, поглощая и удаляя из организма попавшие в желудочно-кишечный тракт вредные вещества. А. применяется для разделения газовых и жидких смесей, для осушки и очистки газов и жидкостей (например, очистки воздуха в противогазах). Одним из древнейших применений А. является очистка вина. В науке и технике приобрёл большое значение хроматографический метод анализа, основанный на различной способности компонентов анализируемой смеси к А. (см. Хроматография). А. используют также для получения и очистки биологически активных веществ - витаминов, ферментов, гормонов, антибиотиков и др.
При крашении тканей, в полиграфической промышленности имеют дело с А. молекул красителей. При производстве полимеров наполнителями служат адсорбенты. В вакуумной технике А. на стенках откачиваемой аппаратуры замедляет скорость откачки и ухудшает вакуум, однако, с другой стороны, действие различных сорбционных насосов основано на явлении А. В радиоэлектронной промышленности А. используется для стабилизации электрических свойств полупроводниковых приборов. Вообще во всех явлениях и процессах, где существенны поверхностные свойства, А. играет важную роль.
Лит.: Курс физической химии, т. 1, М., 1964; Бур Я.Х., Динамический характер адсорбции, пер. с англ., М., 1962; Трепнел Б., Хемосорбция, пер. с англ., М., 1958; Бладергрен В., Физ. химия в медицине и биологии, пер. с нем., М., 1951.
В.И. Шимулис.
Типичные изотермы мономолекулярной адсорбции на однородной поверхности.
адсорбция
ж.
Поглощение, всасывание вещества из раствора или газа поверхностью твердого тела или поверхностным слоем жидкости.
Поглощение, всасывание вещества из раствора или газа поверхностью твердого тела или поверхностным слоем жидкости.
Wikipedia
Адсорбция
Адсорбция (лат. ad — на, при, в; sorbeo — поглощаю) — самопроизвольный процесс увеличения концентрации растворённого вещества у поверхности раздела двух фаз (твёрдая фаза — жидкость, конденсированная фаза — газ) вследствие нескомпенсированности сил межмолекулярного взаимодействия на разделе фаз. Адсорбция является частным случаем сорбции, процесс, обратный адсорбции — десорбция.
Beispiele aus Textkorpus für Адсорбция
1. Возможна, в частности, адсорбция на наночастицах различных контаминантов и облегчение их транспорта внутрь клетки, что резко увеличивает токсичность последних.
2. Технология электроимпульсной обработки воды и промышленных стоков представляет собой так называемый деструктивный метод, в основу которого, в отличие от регенеративных методов, удаляющих примеси из воды в твердую (адсорбция), газовую (десорбция) или неводную жидкую (экстракция) фазы, положено внесение химических изменений в структуру и состав молекул примесей.
3. Теория самосборки Мы не знаем пока механизма самосборки ДНК, однако очень может быть, что вероятность этого процесса повышают какие-то неясные пока факторы - например, как считает академик Юшкин, совместная адсорбция необходимых атомов на кусочках минералов, упрощающая реакцию соединения в миллиарды раз.
4. При неудержимых поносе и рвоте очень важно предупредить развитие обезвоживания специальным раствором (на 1 литр воды 2 столовые ложки сахара, полчайной ложки соли и столько же питьевой соды). Принимать такой раствор нужно по одной столовой ложке каждые 2 - 3 минуты (при рвоте) и по 0, 5 - 1 стакану после каждого стула (при диарее). Другое допустимое доврачебное мероприятие - адсорбция выделяемых микробами токсинов активированным углем или биопрепаратом полифепан.

